O Número de Oxidação (NOX) de um elemento químico é a carga que ele recebe em uma reação química. Por exemplo, no H2SO4
o H ficará com carga +1 (cada átomo de hidrogênio), o S (enxofre) com +6, e o O com uma carga de -2 (cada átomo de oxigênio).
Para saber qual é o NOX de um átomo dentro de uma molécula, devemos seguir algumas regras:
1 – Todos os metais alcalinos, hidrogênio (H) e prata (AG) terão nox +1
2 – Metais alcalinos terrosos, zinco(ZN) -> nox +2
3 – Alumínio (Al) -> nox +3
4 – Oxigênio (em qualquer parte da molécula) -> nox -2
5 – calcogênios (somente se aparecerem na extremidade direita da fórmula!) -> nox -2
6 – Halogênios (somente se aparecerem na extremidade direita da fórmula!) -> nox -1
7 – Íons compostos -> nox igual a carga do íon (por exemplo, PO4-3 terá NOX -3)
8 – Soma de todos os NOX de uma molécula sempre será ZERO.
9 – Soma do NOX em íon sempre será a própria carga do íon.
10 – Elementos isolados e substâncias simples -> nox ZERO.
2 – Metais alcalinos terrosos, zinco(ZN) -> nox +2
3 – Alumínio (Al) -> nox +3
4 – Oxigênio (em qualquer parte da molécula) -> nox -2
5 – calcogênios (somente se aparecerem na extremidade direita da fórmula!) -> nox -2
6 – Halogênios (somente se aparecerem na extremidade direita da fórmula!) -> nox -1
7 – Íons compostos -> nox igual a carga do íon (por exemplo, PO4-3 terá NOX -3)
8 – Soma de todos os NOX de uma molécula sempre será ZERO.
9 – Soma do NOX em íon sempre será a própria carga do íon.
10 – Elementos isolados e substâncias simples -> nox ZERO.
Exemplos
HCl
Hidrogenio se enquadra na regra 1 -> nox +1
O cloro se enquadra na regra 6 -> nox -1
O cloro se enquadra na regra 6 -> nox -1
1 – 1 = 0 (regra 8)
HClO
Hidrogênio -> nox +1
Cl -> não há regra que se aplica
Oxigênio -> nox -2
Cl -> não há regra que se aplica
Oxigênio -> nox -2
nox H + nox Cl + nox O = 0 , logo 1 + x + (-2) = 0, logo o NOX do Cloro será +1
OBSERVAÇÃO: um átomo que não se encaixe as regras (como o Cloro), não precisa ter o mesmo NOX em todas as moléculas. Acima notamos que no HCl, ele tem NOX = -1 , e no HClO, tem nox +1
CaCO3
Neste caso, precisamos multiplicar o nox, das regras, pelo numero de átomos do elemento na molécula.
NOX oxigênio = -2 . 3 (porque são 3 átomos de oxigênio!)
NOX Ca = alcalino terroso = +2
Para descobrir o NOX do Carbono:
(-2 . 3) + 2 + X = 0
-6 + 2 + X = 0
NOX Ca = alcalino terroso = +2
Para descobrir o NOX do Carbono:
(-2 . 3) + 2 + X = 0
-6 + 2 + X = 0
Logo o NOX do carbono será +4
Guilherme , Arthur , André , William , Wellerson

 : quantidade de cargas (C)
: quantidade de cargas (C)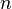 : prótons em excesso
: prótons em excesso : elétrons em excesso
: elétrons em excesso : carga elementar
: carga elementar : tempo (s)
: tempo (s) : intensidade da corrente elétrica (A)
: intensidade da corrente elétrica (A)



 ou
ou 
 ,
, é a constante de permissividade eletrica no vacuo e
é a constante de permissividade eletrica no vacuo e  é a distância entre as cargas.
é a distância entre as cargas. .
. é definido como a energia potencial por unidade de carga:
é definido como a energia potencial por unidade de carga: .
. , podemos definir a energia em função do potencial elétrico:
, podemos definir a energia em função do potencial elétrico: .
. 2NH3(g)
2NH3(g)

![K_c = \frac{[\mbox{Y}]^\mbox{y} \cdot [\mbox{Z}]^\mbox{z}}{[\mbox{A}]^\mbox{a} \cdot [\mbox{B}]^\mbox{b}}](http://upload.wikimedia.org/wikipedia/pt/math/5/1/7/51703a85a9679b9a023dcaea08e824a3.png)
 é uma grandeza chamada de constante de equilíbrio da reação. Cada reação de equilíbrio possui a sua constante, a qual sempre possui o mesmo valor para uma mesma
é uma grandeza chamada de constante de equilíbrio da reação. Cada reação de equilíbrio possui a sua constante, a qual sempre possui o mesmo valor para uma mesma ![K_c = \frac{[\mbox{SO}_\mbox{3}]^\mbox{2}}{[\mbox{SO}_\mbox{2}]^\mbox{2} \cdot [\mbox{O}_\mbox{2}]}](http://upload.wikimedia.org/wikipedia/pt/math/6/6/9/669648c488faff47fe9eb3b61a9fff5f.png)
 , onde ΔG é a energia livre de Gibbs, T a temperatura absoluta e ΔS e a variação da entropia.
, onde ΔG é a energia livre de Gibbs, T a temperatura absoluta e ΔS e a variação da entropia. ( É possível por ser função de estado )
( É possível por ser função de estado ) , onde U e a energia interna, P é a pressão e V o volume.
, onde U e a energia interna, P é a pressão e V o volume. (III),
(III), (IV)
(IV) (V)
(V) , onde TdS = 0 pois,
, onde TdS = 0 pois, , onde PdV = 0
, onde PdV = 0 , onde n é o nº de
, onde n é o nº de 
 (VI) , onde lnP é o logaritmo de base e de P.
(VI) , onde lnP é o logaritmo de base e de P.![\Delta G = \Delta G^0 + RTln[X/Y]](http://upload.wikimedia.org/wikipedia/pt/math/e/a/e/eae82c10c52c46df81e90a8e106ae7d8.png)
 , onde Q é o quociente da reação.
, onde Q é o quociente da reação. , concluindo:
, concluindo:
![K = K_1/K_2 = [Produtos]/[Reagentes] \rightarrow K_1[Reagentes] = K_2[Produtos]](http://upload.wikimedia.org/wikipedia/pt/math/2/a/e/2ae49be7057ea8f84b9b0a597396da9c.png)
![K = K_1/K_2 = [e^{(-Gp/RT)}]/[e^{(-Gr/RT)}]](http://upload.wikimedia.org/wikipedia/pt/math/2/e/e/2eeabf40fbf5fee9afe30ba09765f9b5.png)
![K = \left \{ e^{[(-Hp/RT)+(TS/RT)]} \right \} / \left \{ e^{[(-Hr/RT)+(TS/RT)]} \right \}](http://upload.wikimedia.org/wikipedia/pt/math/5/9/1/59159069848307534f13e7c257a1af09.png)
![K'_c = \frac{[\mbox{PCl}_\mbox{3}]^\mbox{2}}{[\mbox{P}]^\mbox{2} \cdot [\mbox{Cl}_\mbox{2}]^\mbox{3}}](http://upload.wikimedia.org/wikipedia/pt/math/9/a/e/9ae46319b6bbb59385f30be8d5e62b88.png)
![K''_c = \frac{[\mbox{PCl}_\mbox{5}]}{[\mbox{PCl}_\mbox{3}] \cdot [\mbox{Cl}_\mbox{2}]}](http://upload.wikimedia.org/wikipedia/pt/math/9/4/8/9488f9a0697fc40d3aad5ea69e872df7.png)
![K_c = \frac{[\mbox{PCl}_\mbox{5}]^\mbox{2}}{[\mbox{P}]^\mbox{2} \cdot [\mbox{Cl}_\mbox{2}]^\mbox{5}}](http://upload.wikimedia.org/wikipedia/pt/math/2/4/0/240c99d98304c0b322992ffb177e7a06.png)

![K_c = \frac{[\mbox{PCl}_\mbox{3}]^\mbox{2}}{[\mbox{P}]^\mbox{2} \cdot [\mbox{Cl}_\mbox{2}]^\mbox{3}} \cdot \frac{[\mbox{PCl}_\mbox{5}]}{[\mbox{PCl}_\mbox{3}] \cdot [\mbox{Cl}_\mbox{2}]} \cdot \frac{[\mbox{PCl}_\mbox{5}]}{[\mbox{PCl}_\mbox{3}] \cdot [\mbox{Cl}_\mbox{2}]} = \frac{[\mbox{PCl}_\mbox{5}]^\mbox{2}}{[\mbox{P}]^\mbox{2} \cdot [\mbox{Cl}_\mbox{2}]^\mbox{5}}](http://upload.wikimedia.org/wikipedia/pt/math/1/a/4/1a4d1db0e44fb188830846f76fd63942.png)
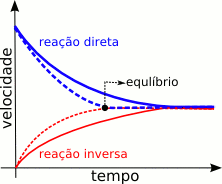
 ); e é possível encontrar uma relação entre as constantes de velocidade das reações direta e indireta, e a constante de equilíbrio.
); e é possível encontrar uma relação entre as constantes de velocidade das reações direta e indireta, e a constante de equilíbrio.![K_c = \frac{[\mbox{X}] \cdot [\mbox{Y}]}{[\mbox{A}]^\mbox{2}}](http://upload.wikimedia.org/wikipedia/pt/math/f/1/1/f114f6bdd26794610388e49646b28243.png)
 ):
):![r = k \cdot [\mbox{A}]^\mbox{2}](http://upload.wikimedia.org/wikipedia/pt/math/4/1/3/413f14473b63c542fababeee8af7559a.png)
![r' = k' \cdot [\mbox{X}] \cdot [\mbox{Y}]](http://upload.wikimedia.org/wikipedia/pt/math/7/3/f/73f830aac9f782e0f3c8c69d9ed629b5.png)
![k \cdot [\mbox{A}]^\mbox{2} = k' \cdot [\mbox{X}] \cdot [\mbox{Y}]](http://upload.wikimedia.org/wikipedia/pt/math/7/4/8/7485c36884ed5124a95a243827604b03.png)
![\frac{[\mbox{X}] \cdot [\mbox{Y}]}{[\mbox{A}]^\mbox{2}} = \frac{k}{k'}](http://upload.wikimedia.org/wikipedia/pt/math/5/a/1/5a1e11c6f93f2acdec57183003fbd4cb.png)


 ,
,  ,
,  ,
,  e assim por diante as constantes de velocidades de cada etapa.
e assim por diante as constantes de velocidades de cada etapa.![K_c = \frac{[\mbox{NiCO}_\mbox{4}]}{[\mbox{CO}]^\mbox{4}}](http://upload.wikimedia.org/wikipedia/pt/math/2/7/e/27e2e8bc5301e7a0255c1baa0fa160ed.png)
 ,
, é a
é a 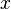 qualquer (ou seja, a pressão que ele teria caso estivesse apenas ele no recipiente),
qualquer (ou seja, a pressão que ele teria caso estivesse apenas ele no recipiente),  é o número de mols do gás,
é o número de mols do gás,  é a constante dos gases perfeitos, e
é a constante dos gases perfeitos, e  a temperatura em
a temperatura em 

 , em vez de
, em vez de ![K_c = \frac{[\mbox{NO}_\mbox{2}]^\mbox{2}}{[\mbox{N}_\mbox{2} \mbox{O}_\mbox{4}]}](http://upload.wikimedia.org/wikipedia/pt/math/a/7/0/a70bbc291ec0ee7f3a6235db477bf43f.png)
 ), então teremos:
), então teremos: