O Número de Oxidação (NOX) de um elemento químico é a carga que ele recebe em uma reação química. Por exemplo, no H2SO4
o H ficará com carga +1 (cada átomo de hidrogênio), o S (enxofre) com +6, e o O com uma carga de -2 (cada átomo de oxigênio).
Para saber qual é o NOX de um átomo dentro de uma molécula, devemos seguir algumas regras:
1 – Todos os metais alcalinos, hidrogênio (H) e prata (AG) terão nox +1
2 – Metais alcalinos terrosos, zinco(ZN) -> nox +2
3 – Alumínio (Al) -> nox +3
4 – Oxigênio (em qualquer parte da molécula) -> nox -2
5 – calcogênios (somente se aparecerem na extremidade direita da fórmula!) -> nox -2
6 – Halogênios (somente se aparecerem na extremidade direita da fórmula!) -> nox -1
7 – Íons compostos -> nox igual a carga do íon (por exemplo, PO4-3 terá NOX -3)
8 – Soma de todos os NOX de uma molécula sempre será ZERO.
9 – Soma do NOX em íon sempre será a própria carga do íon.
10 – Elementos isolados e substâncias simples -> nox ZERO.
2 – Metais alcalinos terrosos, zinco(ZN) -> nox +2
3 – Alumínio (Al) -> nox +3
4 – Oxigênio (em qualquer parte da molécula) -> nox -2
5 – calcogênios (somente se aparecerem na extremidade direita da fórmula!) -> nox -2
6 – Halogênios (somente se aparecerem na extremidade direita da fórmula!) -> nox -1
7 – Íons compostos -> nox igual a carga do íon (por exemplo, PO4-3 terá NOX -3)
8 – Soma de todos os NOX de uma molécula sempre será ZERO.
9 – Soma do NOX em íon sempre será a própria carga do íon.
10 – Elementos isolados e substâncias simples -> nox ZERO.
Exemplos
HCl
Hidrogenio se enquadra na regra 1 -> nox +1
O cloro se enquadra na regra 6 -> nox -1
O cloro se enquadra na regra 6 -> nox -1
1 – 1 = 0 (regra 8)
HClO
Hidrogênio -> nox +1
Cl -> não há regra que se aplica
Oxigênio -> nox -2
Cl -> não há regra que se aplica
Oxigênio -> nox -2
nox H + nox Cl + nox O = 0 , logo 1 + x + (-2) = 0, logo o NOX do Cloro será +1
OBSERVAÇÃO: um átomo que não se encaixe as regras (como o Cloro), não precisa ter o mesmo NOX em todas as moléculas. Acima notamos que no HCl, ele tem NOX = -1 , e no HClO, tem nox +1
CaCO3
Neste caso, precisamos multiplicar o nox, das regras, pelo numero de átomos do elemento na molécula.
NOX oxigênio = -2 . 3 (porque são 3 átomos de oxigênio!)
NOX Ca = alcalino terroso = +2
Para descobrir o NOX do Carbono:
(-2 . 3) + 2 + X = 0
-6 + 2 + X = 0
NOX Ca = alcalino terroso = +2
Para descobrir o NOX do Carbono:
(-2 . 3) + 2 + X = 0
-6 + 2 + X = 0
Logo o NOX do carbono será +4
Guilherme , Arthur , André , William , Wellerson

 : quantidade de cargas (C)
: quantidade de cargas (C)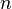 : prótons em excesso
: prótons em excesso : elétrons em excesso
: elétrons em excesso : carga elementar
: carga elementar : tempo (s)
: tempo (s) : intensidade da corrente elétrica (A)
: intensidade da corrente elétrica (A)



 ou
ou 
 ,
, é a constante de permissividade eletrica no vacuo e
é a constante de permissividade eletrica no vacuo e  é a distância entre as cargas.
é a distância entre as cargas. .
. é definido como a energia potencial por unidade de carga:
é definido como a energia potencial por unidade de carga: .
. , podemos definir a energia em função do potencial elétrico:
, podemos definir a energia em função do potencial elétrico: .
.